ACO/ARO/AIO-18.1
Für Patienten
Einleitung
Liebe Patientinnen und Patienten, liebe Angehörige,
auf den nachfolgenden Seiten haben wir für Sie Informationen zum Hintergrund und den Ablauf unserer ACO/ARO/AIO-18.1 Rektumstudie zusammengefasst. Diese Informationen ersetzen selbstverständlich nicht das ärztliche Aufklärungsgespräch, sondern wollen Ihnen einen ersten Überblick geben. Bei weiterführenden Fragen zur Rektumstudie stehen wir Ihnen selbstverständlich jederzeit auch persönlich zur Verfügung. Auch vermitteln wir Ihnen bei Interesse gerne einen Vorstellungstermin in einem unserer teilnehmenden Studienzentren.
Allgemeine Erläuterungen zur klinischen Studie
Klinische Prüfungen sind notwendig, um Erkenntnisse zur Wirksamkeit und Verträglichkeit von Arzneimitteln und deren Kombination mit der Radiotherapie sowie über die optimale Abfolge der Behandlungsbausteine (Chemotherapie, Radiotherapie, Operation) zu gewinnen. Die klinische Prüfung, die wir Ihnen hier vorstellen, wurde – wie es das Gesetz verlangt – von der zuständigen Ethikkommission zustimmend bewertet und von der zuständigen Behörde genehmigt. Diese klinische Prüfung wird an mehreren Orten durchgeführt; es sollen insgesamt 702 Personen teilnehmen. Leiter der klinischen Prüfung ist Prof. Dr. Claus Rödel, Direktor der Klinik für Strahlentherapie und Onkologie des Universitätsklinikums Frankfurt, Goethe-Universität. Sponsor der Studie ist die Goethe-Universität vertreten durch die Präsidentin, übertragen auf den Dekan des medizinischen Fachbereichs der Goethe-Universität Frankfurt/Main. Die Studie wird durch die Stiftung Deutsche Krebshilfe e.V. finanziell gefördert.
Im Rahmen dieser Rektumstudie hat der Sponsor einige Aufgaben und Pflichten bezüglich der Durchführung und Überwachung dieser Klinischen Prüfung an das klinische Auftragsforschungsinstitut, Institut für Klinische Krebsforschung IKF GmbH mit Sitz am Steinbacher Hohl 2-26, 60488 Frankfurt am Main, übertragen (Im Weiteren: CRO, Clinical Research Organization).
Ihre Teilnahme an dieser klinischen Prüfung ist natürlich freiwillig. Sie werden in diese Prüfung also nur dann einbezogen, wenn Sie dazu schriftlich Ihre Einwilligung erklären. Sofern Sie nicht an der klinischen Prüfung teilnehmen oder später aus ihr ausscheiden möchten, erwachsen Ihnen daraus keine Nachteile
Der nachfolgende Text soll Ihnen die Ziele und den Ablauf erläutern. Anschließend und begleitend wird ein Prüfarzt das Aufklärungsgespräch mit Ihnen führen. Bitte zögern Sie nicht, alle Punkte anzusprechen, die Ihnen unklar sind. Sie werden danach ausreichend Bedenkzeit erhalten, um über Ihre Teilnahme zu entscheiden.
Warum wird diese Prüfung durchgeführt?
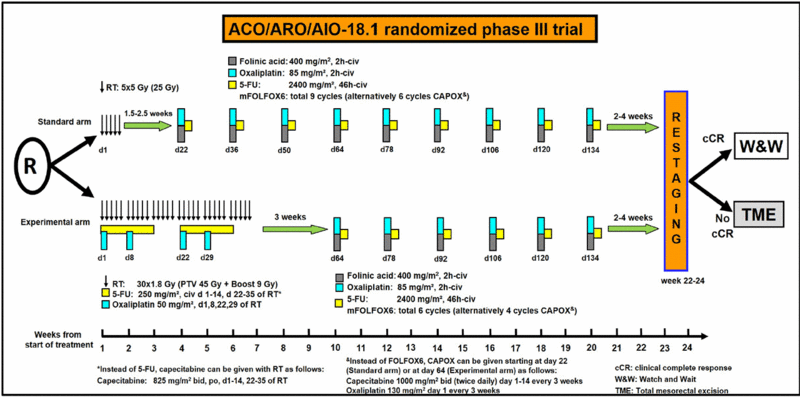
Nach neuesten Erkenntnissen wird für die Therapie des lokal fortgeschrittenen Rektumkarzinoms eine Kombination aus einer präoperativer Kurzzeit-Radiotherapie (5 Bestrahlungsfraktionen über eine Woche) oder einer Radiochemotherapie (RCT) mit 5-Fluorouracil oder Capecitabin über 6 Wochen empfohlen, der sich jeweils eine konsolidierende Chemotherapie (mit Fluorouracil/Capecitabin und Oxaliplatin) über 3 - 4,5 Monaten anschließt. Das Chemotherapeutikum Fluorouracil kann entweder als intravenöse Infusion (über einen Katheter in eine Vene) oder in Tablettenform (Capecitabin) verabreicht werden. Beide Darreichungsformen sind bezüglich Wirksamkeit und Nebenwirkungen prinzipiell als gleichwertig zu betrachten, unser Studienprotokoll erlaubt also beide Darreichungsformen. Zwei bis 4 Wochen nach Abschluss der konsolidierenden Chemotherapie erfolgt normalerweise die Operation (OP) des Tumors. Diese Behandlungsabfolge aus präoperativer Radiotherapie/Radiochemotherapie, konsolidierender Chemotherapie und OP wird als totale neoadjuvante Therapie (TNT) bezeichnet und ist bei Ihrem Tumorstadium der derzeitig empfohlene Therapie-Standard.
Unser Ziel ist es, die Behandlungsergebnisse dieser Standardtherapie bezüglich Wirksamkeit und Verträglichkeit sowie Aspekten der Lebensqualität und des Organerhalts (mit eventuellem Verzicht auf die radikale Operation) weiter zu verbessern. Wir haben nämlich gelernt, dass nach oben beschriebener TNT der Tumor bei der feingeweblichen Aufarbeitung des OP-Präparates durch den Pathologen nicht selten gar nicht mehr nachweisbar ist. Eine solche sog. „pathologische Komplettremission“ wird bei ca. 25-30% der Patienten beschrieben. Wir wollen daher in unserer Rektumstudie nach Abschluss der TNT und vor eigentlich geplanter OP prüfen, ob der Tumor bei Ihnen klinisch überhaupt noch nachweisbar ist. Dazu dienen neben der klinischen Untersuchung (rektal-digitale Austastung des Enddarms) auch die Enddarmspiegelung (Rektoskopie) und eine MRT-Untersuchung des Beckens. Wird bei diesen Untersuchungen übereinstimmend eine klinische Komplettremission des Tumors festgestellt (d.h. der Tumor ist klinisch nicht mehr nachweisbar), kann in unserer Rektumstudie auf die radikale Operation verzichtet werden. Stattdessen werden Patientinnen und Patienten mit einer solchen klinischen Komplettremission in ein engmaschiges Nachsorge-Protokoll aufgenommen (sog. „Watch&Wait-Strategie“, W&W), im Rahmen dessen regelmäßig überprüft wird, ob der Tumor lokal weiterhin vollständig geheilt bleibt. Dies erfordert von Ihnen die Bereitschaft zu einer engen und regelmäßigen Nachsorge (u.a. rektoskopische Untersuchungen alle 3 Monate für 2 Jahre). Nur im Falle eines erneuten lokalen Tumorwachstums erfolgt dann die radikale Operation.
RT = Radiotherapie; Gy = Einheit der Strahlendosis; T = Tag; 5-FU: 5-Fluorouracil; mg = Milligramm; m 2 = Körperoberfläche; h = Stunde; civ = kontinuierliche Infusion über einen Katheter in eine Vene über den angegebenen Zeitraum (z. B. Tag 1- 14)
Ablauf der Rektumstudie
Im Kontrollarm (siehe Abbildung 1) erhalten Sie eine präoperative Kurzzeit-Radiotherapie mit einer Einzeldosis von 5 Gray und 5 Fraktionen für eine Woche. Darin schließt sich 1,5 bis 2,5 Wochen später eine konsolidierende Chemotherapie mit 5-Fluorouracil, Folinsäure und Oxaliplatin (FOLFOX) bzw. alternativ Capecitabin und Oxaliplatin (CAPOX) an. Das Chemotherapeutikum Fluorouracil kann nämlich entweder als intravenöse Infusion (über einen Katheter in eine Vene) oder in Tablettenform (Capecitabin) verabreicht werden. Beide Darreichungsformen sind bezüglich Wirksamkeit und Nebenwirkungen prinzipiell als gleichwertig zu betrachten, unser Studienprotokoll erlaubt also beide Darreichungsformen. Ihr Studienarzt wird mit Ihnen besprechen, welche Darreichungsform er für Sie in Ihrer konkreten Situation empfiehlt. Wird die intravenöse Applikationsform gewählt, so werden 9 Zyklen im Abstand von 2 Wochen appliziert (insgesamt 18 Wochen), wird die orale Gabe gewählt, erfolgen 6 Zyklen im Abstand von 3 Wochen (ebenfalls insgesamt 18 Wochen). Die Verabreichung von Oxaliplatin erfolgt in beiden Fällen intravenös.
Der experimentelle Arm beginnt mit einer konventionell-fraktionierten Radiotherapie (54 Gy in 30 Fraktionen von 1.8 Gy Einzeldosis, 5 Bestrahlungen pro Woche, keine Bestrahlung an den Wochenenden) über 6 Wochen in Kombination mit den Substanzen 5-Fluorouracil oder Capecitabin plus Oxaliplatin in den Wochen 1 und 2 sowie 4 und 5 der Radiotherapie. Dieser Radiochemotherapie schließt sich eine nach Art und Dosierung zum Kontrollarm identische konsolidierende Chemotherapie an, allerdings mit reduzierter Anzahl von 6 Zyklen nach dem FOLFOX-Schema bzw. 4 Zyklen nach dem CAPOX-Schema über jeweils 3 Monate.
In der 22.-24. Woche nach Beginn der RT/RCT erfolgt dann in beiden Armen die Beurteilung des Tumoransprechens. Für beide Behandlungsarme gilt: Sollte der Tumor klinisch so gut angesprochen haben, dass vor der eigentlich geplanten OP in einer rektal-digitalen Untersuchung, einer Spiegeluntersuchung des Enddarms (Rektoskopie) sowie in der Bildgebung (MRT) klinisch kein Tumor mehr nachweisbar sein, spricht man von einer „klinischen Komplettremission“. In einer solchen Situation sieht das Studienprotokoll vor, auf eine radikale OP im Sinne einer W&W-Strategie zu verzichten. Dieses Vorgehen ist prinzipiell in beiden Studienarmen für Patienten erlaubt, die eine solche klinische Komplettremission aufweisen. Wichtig ist dabei allerdings Ihre Bereitschaft zu enger und regelmäßiger Nachsorge innerhalb unserer Rektumstudie. Eine radikale OP des Enddarms im Sinne einer „Rettungschirurgie“ erfolgt bei einem solchen W&W-Vorgehen nur bei Wiederauftreten des Tumors im Enddarm, was nach den bislang vorliegenden Literaturdaten in etwa 20-30% der Fälle innerhalb der ersten beiden Jahre nach Therapieende auftreten kann. Daher wird nach Erreichen einer klinischen Komplettremission eine regelmäßige Nachsorge mittels Enddarmspiegelung und MRT durchgeführt. Die Abstände zwischen den Nachsorgen sind engmaschiger als üblich (alle 3 Monate in den ersten beiden Jahren) und sollen sicherstellen, dass ein mögliches Nachwachsen des Tumors rechtzeitig erkannt wird und die Operation nachgeholt werden kann.
Vor, während und nach der Therapie sind in beiden Armen Untersuchungen notwendig, die sicherstellen, dass Sie die jeweiligen Therapiebausteine protokollgemäß erhalten und gut vertragen werden. Weitere Untersuchungen sollen das Ansprechen des Tumors auf die Therapie anzeigen. Diese klinischen und bildgebenden Untersuchungen sind Standarduntersuchungen. Wir führen in der Rektumstudie also keine apparativ-diagnostischen Untersuchungen, die über die Standardbehandlung hinausgehen, durch, insbesondere keine mit zusätzlicher Strahlenbelastung verbundenen computertomographischen Untersuchungen. Bei Erreichen einer klinischen Komplettremission und Entscheid für ein organerhaltendes Vorgehen ohne primäre OP sind allerdings häufiger Enddarmspiegelungen und MRT-Untersuchungen nötig.
Studiendauer
Die Behandlung in beiden Studienarmen dauert 22-24 Wochen bis zur Operation bzw. bis zum Organerhalt. Während dieser Zeit durchlaufen Sie verschiedene Therapieabschnitte: Radiotherapie bzw. Radiochemotherapie, konsolidierende Chemotherapie und Operation bzw. organerhaltender Verzicht auf OP. Im Falle einer OP ist die Therapie abgeschlossen. Bei Entscheid zum primären Organerhalt erfolgt ebenfalls keine weitere Therapie, sondern eine engmaschige Nachsorge mit Operation nur im Falle des Nachweises eines lokalen Tumor-Wiederwachstums.
Nachsorge
Die Nachbeobachtungszeit der klinischen Prüfung erstreckt sich im Rahmen der Rektumstudie über 3 Jahre und wird nach den Richtlinien der Deutschen Krebsgesellschaft durchgeführt.
Im Falle einer klinischen Komplettremission wird eine regelmäßige Nachsorge mittels Enddarmspiegelung und MRT durchgeführt. Die Abstände zwischen den Nachsorgen sind engmaschiger als üblich (alle 3 Monate in den ersten beiden Jahren) und sollen sicherstellen, dass ein mögliches Nachwachsen des Tumors rechtzeitig erkannt wird und die Operation nachgeholt werden kann.
Im Falle einer Operation werden 4-8 Wochen später noch abschließende Untersuchungen durchgeführt: Körperliche Untersuchung mit der Abfrage Ihrer Beschwerden, Befindlichkeiten, Lebensqualität, Leistungs- und Fitnessstatus, Gewicht, Untersuchung des Tumormarkers im Blut.